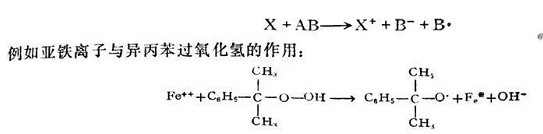
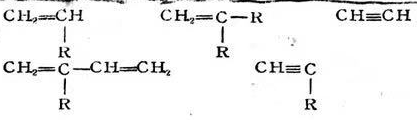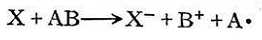過(guò)氧化氫引發(fā)劑的活化能為52千卡/克分子,而其相應(yīng)的氧化還原體系H2O2-Ee"的活化能只有9���,4千卡/克分子�����,異丙苯過(guò)氧化氫的活化能為30千卡/克分子��,但其與亞鐵離子構(gòu)成的氧化還原體系的活化能只有12千卡/克分子��。
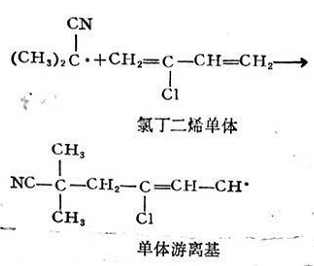
初級(jí)游離基尺·作用于單體分子時(shí)��,激發(fā)雙鍵上的π電子�,使之分離為兩個(gè)獨(dú)立電子,這是需要活化能的���,R與其中一個(gè)獨(dú)立電子結(jié)合�,放出一定的能量����,而生成單體游離基RM。
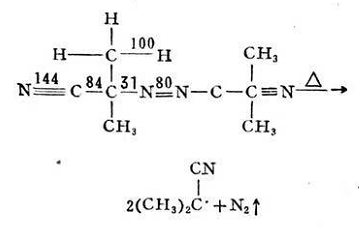
在上述兩步反應(yīng)中�,引發(fā)劑的分解是吸熱反應(yīng),其分解活化能約為30千卡/克分子�����。而形成單體游離基的反應(yīng)是放熱反應(yīng)�����,活化能約為5~8千卡/克分子�����,反應(yīng)極易進(jìn)行,反應(yīng)速度較快��,即初級(jí)游離基R?一旦生成后�����,馬上就與單體M作用��。故游離基RM的生長(zhǎng)率主要決定于引發(fā)劑的分解速度��。
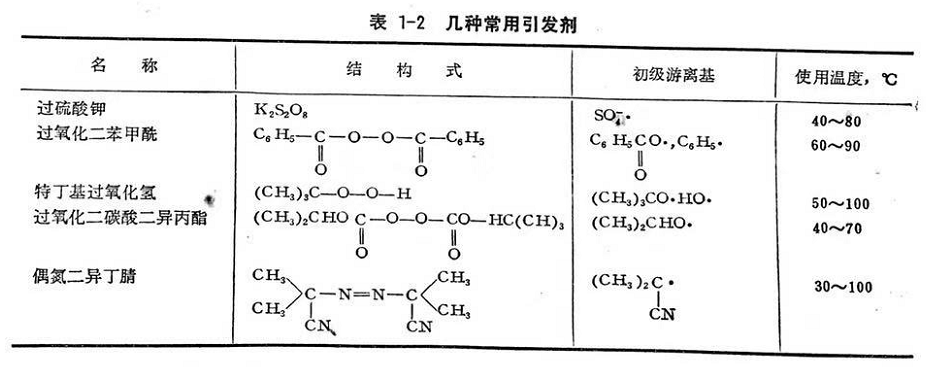
在鏈的引發(fā)階段存在著許多副反應(yīng)�,主要是初級(jí)游離基或單體游離基與氧作用,或者是與雜質(zhì)作用��,這都將影響引發(fā)效率���。要使鏈引發(fā)順利進(jìn)行,就必須嚴(yán)格控制氧���、雜質(zhì)和阻聚劑���,以盡量減少副反應(yīng)。所謂阻聚劑就是一種捕提游離基的物質(zhì)��,它能極迅速與初級(jí)游離基作用,終止鏈反應(yīng)�����。當(dāng)聚合系統(tǒng)內(nèi)有阻聚劑時(shí)�����,就產(chǎn)生誘導(dǎo)期��,直到阻聚劑消耗完后����,聚合作用才正常進(jìn)行。通常�,為防止純凈單體在生產(chǎn)或貯運(yùn)中發(fā)生自然聚合現(xiàn)象,常在單體中加入少量阻聚劑(或叫穩(wěn)定劑)���。如加入0.05~0.1%的對(duì)苯二酚等���。另一種阻滯劑或緩聚劑是只在反應(yīng)初期阻滯聚合速度,使聚合速度減低����,而不產(chǎn)生誘導(dǎo)期�。引發(fā)效率就是引發(fā)劑分解產(chǎn)生的游離基數(shù)目�,用于形成單體游離基的百分?jǐn)?shù),常用f%表示��。通常����,由于副反應(yīng)的存在,以及單體性質(zhì)�、介質(zhì)、引發(fā)劑濃度和反應(yīng)溫度的影響���,初級(jí)游離基的引發(fā)效率一般不能達(dá)到100%���。用同一種引發(fā)劑去引發(fā)不同單體,引發(fā)效率也不同�,見表1-3�。

因?yàn)橐l(fā)劑的分解速度直接關(guān)系到聚合速度,所以需知道引發(fā)劑的分解速度��。由于引發(fā)劑是以端基形式參與聚合物的組成�����,加大引發(fā)劑用量,雖可以加快整個(gè)聚合速度�,但卻使聚合物平均分子量降低。